Техника выполнения мазка и толстой капли крови



1. 70%-ый спирт, предметные стекла, обезжиренные смесью Никифорова, бланки направлений, ручка, стеклограф, спички, круглая резинка, конверт из крафт-бумаги, лоток для сброса, емкость с дезинфицирующим раствором;
2. Стерильные: лоток, индивидуальные перья-копья, пинцет, ватные шарики.
II. Ход манипуляции:
1. Установить доверительные отношения с пациентом;
2. Объяснить цель и ход процедуры;
3. Вымыть и просушить руки;
4. Надеть маску, перчатки;
5. Обработать кожу 4-го пальца руки спиртом;
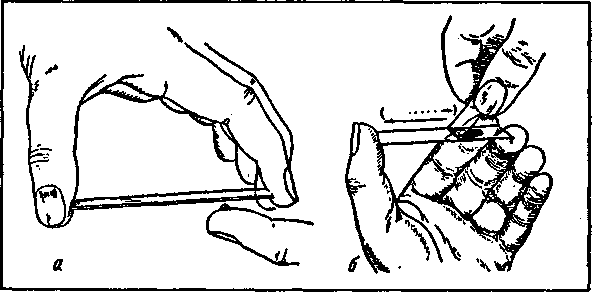
6. Проколоть мякоть последней фаланги 4-го пальца индивидуальным пером-копьем;
7. Поместить перо в лоток для сброса;
8. Снять первую каплю крови сухим ватным шариком;
9. Поместить шарик в емкость с дезинфицирующим раствором;
10. Повернуть палец проколом вниз;
11. Прикоснуться предметным стеклом ко второй капле крови;
12. Приложить ватный шарик к месту прокола;
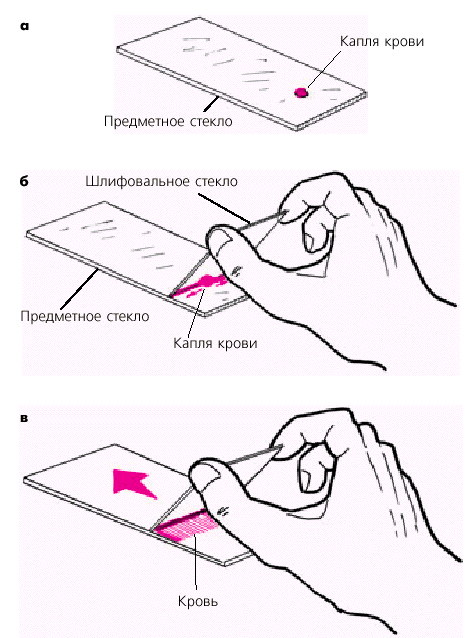
13. Размазать каплю крови на предметном стекле в диск диаметром 10-15 мм углом второго предметного стекла;
14. Обвести толстую каплю крови стеклографом с обратной стороны стекла;
15. Указать регистрационный номер с обратной стороны стекла;
16. Высушить препарат на воздухе в горизонтальном положении, предохраняя от пыли и мух;
17. Поместить толстую каплю между двумя предметными стеклами, используя спичку и круглую резинку;
18. Оформить направление в паразитологическую лабораторию;
19. Поместить препарат в конверт;
20. Отправить конверт в лабораторию сразу же;
21. Провести дезинфекцию лотка, пинцета, шариков, пера-копья;
22. Снять маску, перчатки;
23. Вымыть и просушить руки.
1. Взятие крови проводится немедленно при подозрении на заболевание;
2. При взятии крови строго соблюдать правила асептики;
3. Нельзя пользоваться иглами Франка и иглами от шприца;
4. Предметное стекло держать пальцами за края, чтобы не оставить отпечатков;
5. После высыхания капли через нее должен слабо просвечиваться крупный печатный текст, а при микроскопии должно насчитываться в среднем 10-15 ядер лейкоцитов;
6. На одном стекле можно приготовить 2 толстые капли с двух краев стекла;
7. Кровь лучше брать во время лихорадочного периода и в межприступный период.
Источник
ВЗЯТИЕ КРОВИ И ПРИГОТОВЛЕНИЕ ТОЛСТОЙ КАПЛИ ПРИ МАЛЯРИИ.



ЦЕЛЬ: диагностическая, обнаружение малярийных плазмодиев в крови
ОСНАЩЕНИЕ:
1. 70% раствор спирта этилового и эфир медицинский.
2. Предметные стёкла, обезжиренные смесью Никифорова.
3. Бланки направлений, авторучка.
6. Круглая резинка.
7. Конверт из крафт-бумаги.
8. Лоток для сброса.
9. Ёмкость с дезинфицирующим раствором.
10. Стерильные: лоток, индивидуальные перья-копья, пинцет, ватные шарики.
ПОДГОТОВКА ПАЦИЕНТА И МЕДИЦИНСКОГО РАБОТНИКА:
1. Установить доверительные отношения с пациентом.
2. Объяснить пациенту цель и ход процедуры, получить его согласие.
ТЕХНИКА ВЫПОЛНЕНИЯ:
1. Вымыть и осушить руки.
2. Надеть перчатки и маску.
3. Обработать кожу IV пальца руки пациента спиртом с эфиром.
4. Вскрыть перо – копье, проверив срок годности.
5. Проколоть мякоть латеральной фаланги IV пальца индивидуальным пером-копьём.
6. Поместить перо в лоток для сброса.
7. Снять первую каплю крови сухим ватным шариком.
8. Поместить шарик в ёмкость с дезинфицирующим раствором.
9. Повернуть палец проколом вниз.
10. Прикоснуться предметным стеклом ко второй капле крови в двух местах (при необходимости взять 2 — 3 стекла).
11. Приложить ватный шарик со спиртом к месту прокола.
12. Размазать каплю крови на предметном стекле в диск диаметром 10-15 мм углом второго предметного стекла.
13. Обвести толстую каплю крови стеклографом с обратной стороны стекла.
14. Указать регистрационный номер с обратной стороны стекла.
15. Высушить препарат на воздухе в горизонтальном положении, предохраняя от пыли и мух.
16. Поместить стекло с толстой каплей между двумя предметными стёклами, используя спички и круглую резинку.
17. Поместить препарат в конверт.
ЗАВЕРШЕНИЕ:
1. Оформить направление в паразитологическую лабораторию.
2. Отправить конверт в лабораторию сразу же.
3. Провести дезинфекцию использованного инструментария и оснащения:
· Перо- копьё замочить в 5% растворе хлорамина на 60 минут, затем утилизировать.
· Тампон и марлевую салфетку замочить в 5% растворе хлорамина на 60 минут, а затем утилизировать.
· Лоток обработать двукратным протиранием 3% хлорамином с интервалом 15 минут или погрузить в раствор на 1 час.
· Снять перчатки, опустить в 5% раствор хлорамина на 1 час, затем утилизировать.
5. Вымыть и осушить руки.
ИНСТРУКЦИЯ ПО ЗАБОРУ МАТЕРИАЛА
ПРИ ПОДОЗРЕНИИ НА ЗАБОЛЕВАНИЕ ХОЛЕРОЙ.
ПОМНИ! Испражнения и рвотные массы для лабораторного исследования нужно брать немедленно при выявлении больного и обязательно до начала лечения. Вся посуда для проведения забора материала должна быть стерильной, проверена на целостность и подписана до начала забора материала.
ОСНАЩЕНИЕ:
1. Защитный костюм 4-го типа.
2. Стерильная банка с плотной крышкой.
3. Стерильная ложка или шпатель.
4. Емкости для дезинфицирующих растворов и ветошь.
5. Направление, ручка.
6. Целлофановые пакеты и крафт-бумага.
7. Контейнер или бикс для транспортировки.
9. Резиновое кольцо или шпагат.
10. Лейкопластырь или липкая лента.
ПОДГОТОВКА МЕДИЦИНСКОГО РАБОТНИКА:
1. Приготовить необходимое оснащение.
2. Заполнить направление, завернуть его в целлофановый пакет и положить в бикс.
3. Промаркировать емкости: «1% хлорамин», «3% хлорамин».
4. Надеть защитный костюм 4 типа (длинный медицинский халат, перчатки, шапочку, клеенчатый фартук, маску).
5. Развести хлорамин в 2-х ёмкостях: 3% и 1%.
ТЕХНИКА ВЫПОЛНЕНИЯ:
ПОМНИ! Материал для исследования на холеру берется только из судна или других ёмкостей для сбора испражнений.
1. Взять стерильные ёмкости (баночки) для сбора испражнений с плотными крышками, промаркировать их.
2. Набрать из судна (лотка, таза) испражнения или рвотные массы стерильным шпателем или ложкой до 50 мл.
3. Положить шпатель (ложку) в ёмкость с 3% раствором хлорамина.
4. Наружную поверхность ёмкости (баночки) протиреть ветошью, смоченной в 1% хлорамине.
5. Плотно закрыть крышкой, обернуть крышку крафт-бумагой или поместить в целлофановый пакет, закрепив резиновым кольцом.
6. Поместить емкости с материалом в контейнер или бикс.
7. Обработать руки в перчатках 1% раствором хлорамина.
8. Закрыть контейнер (бикс), обработать 1% раствором хлорамина и заклеить лейкопластырем или липкой лентой.

9. Обработать руки в перчатках 1% раствором хлорамина.
10. Промаркировать контейнер: «ВЕРХ», «НЕ ОТКРЫВАТЬ!».
ЗАВЕРШЕНИЕ:
1. Бикс отправить в бактериологическую лабораторию ЦГСЭН под роспись (3 этаж) с медицинским работником, прошедшим инструктаж. Во время транспортировки бикс не открывать, не болтать и не переворачивать. После доставки материала контейнер (бикс) обрабатывается и доставляется в отделение.
2. Провести дезинфекцию испражнений пациента: засыпать сухой хлорной известью 1: 5, экспозиция 1 час.
3. Провести обработку фартука 3% хлорамином.
4. Снять загрязненные перчатки и погрузить их в 5% хлорамин на 1 час, затем утилизировать.
5. Обработать руки 70% спиртом, надеть стерильные перчатки и начать оральную регидратацию.
6. После ее проведения провести обработку инструментария и рабочего места.
Источник
Манипуляция № 7. Приготовление препаратов «толстая капля» и «тонкий мазок».



Цель: диагностическая.
Показания: Подозрение на малярию.
Противопоказания: нет.
Оснащение:
1. Одноразовая игла-копье (скарификатор)
2. Спирт 70%, стерильные ватные шарики, стерильный пинцет
3. Обезжиренные сухие предметные стекла
4. Предметное стекло с шлифованным краем
6. Перчатки, маска
7. Лоток для использованного материала.
8. Емкость с дез.раствором
Подготовка пациента:
1.Установить доброжелательное отношение с пациентом.
2. Проинформировать пациента о предстоящей манипуляции и ходе ее выполнения, получить информированное согласие.
3. Помочь пациенту занять нужное положение, выбрать для манипуляции руку, менее используемую в быту.
Техника выполнения:
1. Оформить направление, повести гигиеническую обработку рук, надеть перчатки.
Приготовление «Толстой капли крови»:
— обработать дважды место прокола стерильным ватным шариком, смоченным в спирте.
— проколоть иглой – копьём (скарификатором) кожу четвертого пальца.
— убрать первую каплю крови сухим ватным шариком.
— к следующей капле крови прикасаются стеклом в 2 местах на небольшом расстоянии друг от друга, не касаясь пальца. Приложить к месту прокола ватный шарик, смоченный спиртом.
— затем, углом другого стекла или стеклянной палочкой обе капли соединяют и размазывают до диаметра 10-15 мм.
— приготовленный препарат кладут на горизонтальную поверхность для высыхания.
— после высыхания с обратной стороны предметного стекла стеклографом обозначают границы «Толстой капли».
— указать стеклографом на обратной стороне стекла номер в соответствии с номером направления.
Приготовление «тонкого мазка»:
— обработать дважды место прокола стерильным ватным шариком, смоченным в спирте.
— проколоть иглой – копьём (скарификатором) кожу четвертого пальца.
— убрать первую каплю крови сухим ватным шариком.
— прикоснутся ко второй капли крови узкой стороной предметного стекла, отступив от края на 1-2 сантиметра; приложить к месту прокола ватный шарик смоченный спиртом.
— подвести к капле крови шлифованное стекло под углом в 45 градусов; подождать пока кровь не растечется вдоль края соприкосновения пластинок; быстрым и непрерывным движением покровного стекла размазать кровь вдоль поверхности предметного стекла; в горизонтальном положении высушить мазок на воздухе;
— стеклографом указать на обратной стороне стекла номер в соответствии с номером направления.
2. Поместить высушенные мазки в планшет для хранения микропрепаратов, затем в контейнер для транспортировки.
3. Обработать использованный материал в соответствии с требованиями санэпидрежима.
4. Провести гигиеническую обработку рук.
5. Доставить материал в паразитологическую или клиническую лабораторию.
Возможные осложнения: инфицирование.
Примечание:
— Забор крови желательно проводить в период повышения температуры в начале заболевания и на фоне нормальной температуры в конце заболевания для контроля эффективности лечения.
— Обычно для каждого пациента готовят 2-3 толстые капли одновременно и 1 мазок крови.
— На одном предметном стекле могут быть приготовлены «Толстая капля» и «Тонкий мазок».
— Препараты «Толстая капля» и «Тонкий мазок» высушивают при комнатной температуре и окрашивают по методу Романовского – Гимзе.
— После высыхания «Тонкого мазка» через него должен слабо просвечивать крупный печатный текст.
Рис. 16. Приготовление «Тонкого мазка» крови.
Рис. 17. Приготовление «Толстой капли» крови.
Источник
12.Толстая капля крови. Приготовление и окраска.
ТОЛСТАЯ КАПЛЯ КРОВИ
С целью обнаружения гемопаразитов микроскопируют с иммерсионным маслом под большим увеличением мазок (см. курс общеклинических лабораторных исследований) и толстую каплю крови (рис. 9.1).
Толстую каплю в отличие от мазка, крови не фиксируют. Под влиянием водного раствора краски нефиксированные эритроциты гемолизируются, препарат становится прозрачным. Это ускоряет и облегчает нахождение паразитов, так как в одном поле зрения можно исследовать гораздо больший объем крови, чем в мазке.
Если же толстая капля будет зафиксирована, то гемолиза эритроцитов не произойдет, они будут наслаиваться друг на друга и препарат окажется непригодным для микроскопии.
Слой крови в толстой капле не должен быть очень толстым, иначе после высушивания оиа трескается и может отпасть. Нормальной считается толстая капля, через которую после высушивания слабо просвечивает крупный печатный текст, а при микроскопии в одном поле зрения насчитывается в среднем 10—15 ядер лейкоцитов.
Хорошие препараты крови можно приготовить только используя чистые обезжиренные предметные стекла.
Стекла моют горячей водой с мылом или кипятят в 1 % растворе стирального порошка, затем тщательно прополаскивают горячей и дистиллированной водой. Вымытые стекла вытирают хлопчатобумажной тканью или сушат в сухожаровом шкафу, заворачивают в неворсистую бумагу и хранят до употребления.
Приготовление толстой капли крови
Оборудование: предметные стекла (сухие, чистые, обезжиренные); копья или скарификаторы одноразового применения для прокола кожи; вата; 70 % этанол; эфир; простой и восковый карандаши.
Методика работы. 1. Несколько чистых предметных стекол положить на стол.
2. Ватой, смоченной 70 % этанолом, протереть концевую фалангу IV пальца левой руки пациента (на занятии учащиеся
берут кровь для приготовления препаратов друг у друга).
3. После высыхания этанола проколоть кожу пальца с ладон6 — этапы приготовления тонкого мазка; 7—9 — неправильно приготовленные мазкн; 10—12 — разные способы приготовления толстой каплн.
ной стороны копьем, ставя плоскость копья поперечно к линиям кожного рисунка.
4. Выступившую первую каплю крови снять сухой ватой.
5. Нажимая на боковые поверхности пальца по направлению
к месту прокола (палец пациента при этом держат опущенным)
выдавить крупную каплю крови.
6. Предметным стеклом, держа его за боковые ребра, прикоснуться и снять выступившую каплю крови, которую располагают отступя на 2—2,5 см от узкого края стекла.
7. Круговыми движениями стекла размазать каплю, доводя ее размер до 1,5 см в диаметре.
8. Точно так же приготовить толстую каплю на другой половине стекла. Расстояние между каплями должно быть не менее 2 см.
9. В промежутке между каплями нанести на стекло полоску крови, на которой после высушивания написать простым каран-шом номер по списку или фамилию пациента. Делать подобную надпись на поверхности толстой капли недопустимо, так как это портит препарат и затруднит микроскопическое исследование.
10. Стекла в горизонтальном положении положить на стол (в
кювету) для просушивания, предохраняя от попадания прямых
солнечных лучей, пыли и мух.
11. Ранку на пальце обработать ватой, смоченной этанолом.
ОКРАСКА ТОЛСТОЙ КАПЛИ КРОВИ
Чем выше температура в помещении, тем быстрее окрашивается препарат, и наоборот. В среднем мазок окрашивается в течение 45—50 мин, толстая капля — 15—30 мин.
Если толстые капли сохранялись более недели неокрашенными, что само по себе действует как слабая фиксация, особенно в условиях жаркого климата, то препараты после окраски могут получиться недостаточно прозрачными из-за неполного гемолиза эритроцитов.
В таких случаях предварительно следует налить на препарат несколько капель дистиллированной воды. Через 10—15 мин гемоглобин эритроцитов переходит в воду, придавая ей буроватый оттенок, а толстая капля становится белесоватой. Воду сливают, каплю осторожно прополаскивают дистиллированной водой и затем наливают краску.
Можно окраску проводить и в специальных контейнерах, в которых стекла расположены на ребре, а выпадающая в осадок краска не портит препарат. Однако при этом возрастает риск смывания толстой капли со стекла.
Правильно окрашенная толстая капля имеет фиолетовый цвет, перекрашенная — темно-фиолетовый, недокрашенная — светло-голубой. Длительно хранившаяся при высокой температуре или зафиксированная толстая капля приобретает почти черный цвет.
Техника окраски толстой капли крови
Оборудование: плоская ванночка или кювета; подставки для окраски и сушка стекол; иипеткн; краска Романовского; дистиллированная вода или фосфатный буферный раствор; иммерсионное масло; вата; эфир; препараты крови для окрашивания; микроскоп.
Методика работы. 1. Предметные стекла с сухими толстыми каплями крови положить на подставку над кюветой препаратами кверху. Стекла не должны соприкасаться.
2. В стакан- налить дистиллированную воду или, лучше, фосфатный буферный раствор и добавить пипеткой краску Романовского из расчета 1 каплю на 1 мл воды.
3. Пипеткой нанести разведенный рабочий раствор краски так, чтобы она полностью покрыла препараты без образования пузырьков.
4. Оставить краску на препаратах на 30 мин, следя за тем, чтобы краска не стекла с препаратов, добавляя ее при необходимости пипеткой.
5. По окончании процедуры каждое стекло, не сливая с него краски, осторожно промыть слабой струей воды, например из стакана (сильная струя воды может смыть толстую каплю), до тех пор, пока промывная вода не станет бесцветной.
Примечание. Если сначала слить краску, а затем промывать, то образовавшаяся пленка краски может испортить препарат или послужить причиной диагностической ошибки.
6. Предметные стекла поместить в подставку для просушки в
вертикальном или наклонном положении, предохраняя от попадания пыли и солнечных лучей.
. 7. После просушивания препараты исследовать под микрокопом с масляной иммерсией. Оценить качество толстой капли и ее окраски.
8. Совместно с преподавателем провести микроскопию готовых препаратов малярийных плазмодиев в мазке и толстой капле крови.
Источник