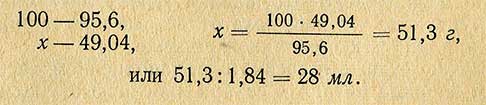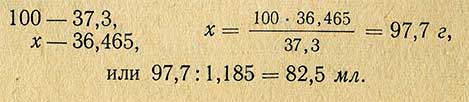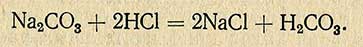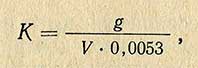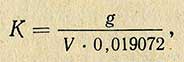- КАЛЬЦИМЕТРЫ
- РАЗДЕЛЫ
- ПРАКТИЧЕСКИЕ СОВЕТЫ
- Содержание
- 1. Определение плотности соляной кислоты.
- 2. Определение концентрации водных растворов соляной кислоты.
- 3. Приготовление водных растворов соляной кислоты в заданном объемном соотношении.
- 4. Приготовление водных растворов соляной кислоты требуемой весовой концентрации.
- 5. Приготовление водных растворов соляной кислоты заданной молярной концентрации.
- 6. Расход соляной кислоты для определения карбонатности образцов горной породы.
- 7. Подготовка образца
- 8. Нейтрализация остатков соляной кислоты
- Приготовление титрованных растворов серной и соляной кислот
- Установка титра по углекислому натрию
- Установка титра кислот по буре
- Приготовление рабочих растворов.
КАЛЬЦИМЕТРЫ

набережная реки Лазури, 15 geosfera@geosferatver.ru
tver@upeg.net
| производство и поставка оборудования |
РАЗДЕЛЫПРАКТИЧЕСКИЕ СОВЕТЫСодержание1. Определение плотности соляной кислоты.Пример. Кислота отобрана в шприц, полный объем которого V = 24,6 см 3 . Масса кислоты, измеренная на электронных весах, m = 29,175 г. 2. Определение концентрации водных растворов соляной кислоты.Пример. Масса раствора соляной кислоты объемом 24,6 см 3 равна 26,2 г. Необходимо определить, в каком объемном соотношении концентрированная кислота смешана с водой, исходную концентрацию, а также весовую и молярную концентрацию (нормальность) раствора. 3,881 + (4,004 – 3,881)·(36,5 – 36,0) = 3,942 моль/л Затем по таблице 5 определите весовую концентрацию раствора: 13,30 + (13,69 – 13,30)·(36,5 – 36,0) = 13,49 % вес. 3. Приготовление водных растворов соляной кислоты в заданном объемном соотношении.Пример. Для приготовления 500 мл раствора в объемном соотношении 1:4 необходимо 100 мл концентрированной кислоты аккуратно влить в 400 мл дистиллированной воды, тщательно перемешать и перелить раствор в емкость из темного стекла с герметичной крышкой. 4. Приготовление водных растворов соляной кислоты требуемой весовой концентрации.Пример. Необходимо приготовить 1 л раствора HCL концентрацией 6 % вес. из соляной кислоты концентрацией 36 % вес. (такой раствор используется в карбонатомерах КМ производства ООО НПП «Геосфера»). 1,692 / 11,643 = 0,1453 л. Следовательно, добавив 145 мл кислоты (36 % вес.) в 853 мл дистиллированной воды, получите раствор заданной весовой концентрации. 5. Приготовление водных растворов соляной кислоты заданной молярной концентрации.Vв = V(M/Mp – 1) где M – молярная концентрация исходной кислоты. Пример. Весовая концентрация используемой кислоты 36,3 % вес. Необходимо приготовить 1 л водного раствора HCL с молярной концентрацией 2,35 моль/л. 11,643 + (12,011 – 11,643)·(36,3 – 36,0) = 11,753 моль/л По приведенной выше формуле рассчитайте объем воды: Vв = V (11,753 / 2,35 – 1) = 4·V Принимая Vв + V = 1 л, получите значения объемов: Vв = 0,2 л и V = 0,8 л. Следовательно, для приготовления раствора с молярной концентрацией 2,35 моль/л, нужно влить 200 мл HCL (36,3 % вес.) в 800 мл дистиллированной воды. 6. Расход соляной кислоты для определения карбонатности образцов горной породы.CaCO3 + 2HCL = CaCL2 + H2O + CO2 CaMg(CO3)2 + 4HCL = CaCL2 + MgCL2 + 2H2O + 2CO2 FeCO3 + 2HCL = FeCL2 + H2O + CO2 Наибольшее количество кислоты расходуется на разложение доломита, т.к. в 1 г CaMg(CO3)2 содержится 21,691 мг-экв., в 1 г CaCO3 – 19,982 мг-экв., а в 1 г FeCO3 – 17,262 мг-экв. Для полного разложения карбонатов необходимо израсходовать такое же количество мг-экв. HCL. В 1 мл концентрированной соляной кислоты (35…38% вес.) содержится 11,267…12,381 мг-экв. (таблица 1). Поэтому на разложение 1 г доломита теоретически необходимо от 21,691 / 12,381 = 1,75 мл до 21,691 / 11,267 = 1,92 мл концентрированной кислоты (таблица 7). При проведении исследований образцов горных пород расход концентрированной кислоты должен быть не менее 2 мл на 1 г карбонатных веществ. Избыток кислоты необходим для нормального протекания химической реакции. Для карбонатомеров серии КМ производства ООО НПП «Геосфера» расход концентрированной соляной кислоты на один образец составляет не более 2,35 мл. 7. Подготовка образцаДля определения карбонатности горной породы необходима навеска измельченного образца массой от 500 мг до 1000 мг. Навеска большей массы позволяет достовернее определить содержание кальцита и доломита, особенно в низкокарбонатных образцах. Для получения навески массой 1000 мг нужно отобрать и измельчить не менее 3 г сухих флагментов керна или промытых и высушенных частиц шлама основной породы. После измельчения образца необходимо просеять порошок через сито с размером ячеек 0,056 мм или 0,063 мм. Если образец отобран из нефтенасыщенного керна или шлама, то после измельчения следует выполнить экстрагирование образца органическим растворителем (четыреххлористым углеродом CCl4 или хлороформом CHCl3). Для экстрагирования просеянный порошок необходимо насыпать кучно на листок фильтровальной бумаги и с помощью пипетки нанести на него под вытяжкой 30…40 капель растворителя. После испарения растворителя из образца нужно отобрать навеску для взвешивания. Взвешивание следует осуществлять на электронных весах не ниже 3 класса точности, имеющих дискретность отсчета не менее 1 мг. Взвешиваемый образец рекомендуется насыпать на подложку из плотной мелованной бумаги (для удобства последующей засыпки в контейнер реакционной камеры карбонатомера). Следует учитывать, что неточное взвешивание образца увеличивает погрешность определения карбонатности. Например, при погрешности взвешивания ± 10 мг дополнительная ошибка определения карбонатности образца массой 500 мг составляет ± 2%. 8. Нейтрализация остатков соляной кислотыДля нейтрализации остатков HCl необходимо добавить в раствор равное количество мг-экв. одного из веществ, взаимодействующих с соляной кислотой (например, бикарбонат натрия NaHCO3, бикарбонат калия KHCO3, углекислый натрий Na2CO3, углекислый калий K2CO3, гидроокись натрия NaOH или гидроокись калия KOH). Расчетное количество безводных веществ, затрачиваемых на нейтрализацию кислоты, содержащейся в 1 мл водных водных растворов HCl разной концентрации, приведено в таблице 10. Количество вещества, используемого для нейтрализации остатков HCl после исследования образца породы массой 1 г, может быть определено исходя из объема раствора кислоты, не затраченной на реакцию. Пример. При исследовании образца породы массой 1 г, содержащего 85% кальцита, израсходовано 15 мл водного раствора HCl (1:6), приготовленного из кислоты с концентрацией 38% вес. Необходимо определить количество NaHCO3 для нейтрализации остатков HCl после реакции. Расчетный объем раствора кислоты для разложения 1 г CaCO3 равен 11,3 мл (таблица 8). Избыток раствора HCl составляет 15,0 – 11,3 = 3,7 мл. Расчетное количество непрореагированной кислоты равно 11,3·(1 – 85/100) = 1,7 мл. Следовательно, необходимо нейтрализовать кислоту в растворе объемом 3,7 + 1,7 = 5,4 мл. Используя таблицу 10, рассчитываем требуемое для нейтрализации количество безводного бикарбоната натрия 0,149 · 5,4 = 0,8 г. Фактический расход безводных веществ, используемых для нейтрализации остатков кислоты в 1 мл раствора, больше расчетных значений (таблица 10) на величину (100/C -1)% где С – весовая доля чистого вещества в безводном порошке, % вес. Пример. Для нейтрализации кислоты, содержащейся в 1 мл разбавленного (1:6) раствора HCl с начальной концентрацией 38 % вес. согласно таблице 10 необходимо 0,099 г KOH. Весовая доля KOH равна 88 % вес. Фактическое количество вещества, затрачиваемого на нейтрализацию кислоты больше расчетного и равно Из химических веществ, пригодных для нейтрализации соляной кислоты, наиболее доступным является бикарбонат натрия NaHCO3 по ГОСТ 2156-76 (он же двууглекислый натрий или пищевая сода). Источник Приготовление титрованных растворов серной и соляной кислотГрамм-эквивалент серной кислоты равен 49,04 (98,08:2), соляной — 36,465. Следовательно, для приготовления нормальных растворов необходимо взять серной или соляной кислоты в количествах, соответствующих этим величинам. Титрованные растворы серной и соляной кислот приготовляют из химически чистых концентрированных растворов этих кислот. Необходимое количество кислот рассчитывают следующим образом. Предположим, имеется серная кислота относительной плотностью 1,84 (95,6%), необходимо приготовить 1 л 1 н. раствора кислоты, для этого следует взять концентрированной кислоты: Таким же способом рассчитывают необходимое количество соляной кислоты. Если относительная плотность концентрированной кислоты 1,185 (37,3%), то для приготовления 1 л 1 н. раствора ее необходимо взять: Необходимое количество кислоты отмеривают по объему, выливают в воду, охлаждают, затем переносят в мерную колбу емкостью 1 л и доводят объем до метки. Титр кислот устанавливают по химически чистым реактивам: углекислому натрию, буре или по титрованному раствору едкого натра. Установка титра по углекислому натриюВ отдельные бюксы берут с точностью до 0,0001 г три навески карбоната натрия по 0,15-0,20 г (для 0,1 н. раствора) и сушат при 150° С до постоянной массы (веса). После этого навески переносят в конические колбы емкостью 250 мл и растворяют в 25 мл дистиллированной воды. Бюкс снова взвешивают и определяют по разности массу (вес) навески высушенного реактива. К раствору в колбе прибавляют индикатор — 1-2 капли метилового оранжевого и титруют приготовленным раствором кислоты до изменения окраски от желтой к оранжево-желтой. Коэффициент поправки рассчитывают по формуле (для 0,1 н. раствора) где g — навеска соли, г; V — количество кислоты, израсходованное на титрование, мл; 0,0053 — количество карбоната натрия, соответствующее 1 мл точно 0,1 н. раствора кислоты, г. Установка титра кислот по буреБуру предварительно высушивают между листами фильтровальной бумаги до тех пор, пока отдельные кристаллики не перестанут прилипать к стеклянной палочке. Буру лучше сушить в эксикаторе, заполненном насыщенным раствором хлорида натрия и сахара или насыщенным раствором бромида натрия. Берут с точностью до 0,0001 г три навески буры в бюксы в количестве 0,5 г (для 0,1 н. раствора) и переносят в конические колбы емкостью 250 мл, бюксы взвешивают и по разности устанавливают точную массу (вес) навески. Затем приливают к навескам по 30-60 мл теплой воды, энергично взбалтывая. Затем, добавив 1-2 капли раствора метилового красного, титруют раствор буры приготовленным раствором кислоты до перехода окраски из желтой в красную. Поправочный коэффициент рассчитывают по следующей формуле: где значение букв такое же, как и в предыдущей формуле; 0,019072 — количество буры, соответствующее 1 мл точно 0,1 н. раствора кислоты, г. Источник Приготовление рабочих растворов.
|